CTC College
CTC學院
在傳統臨床實踐中,獲得腫瘤患者組織樣本只有手術活檢和穿刺活檢兩種。轉移期腫瘤患者體內可能有多個腫瘤病灶,具體到從哪個病灶獲取腫瘤組織樣本是一大問題。
腫瘤患者血液中存在少量循環腫瘤細胞以及由壞死癌細胞釋放的少量循環腫瘤 DNA。通過檢測血液中的循環腫瘤細胞(CTC,circulating tumor cell)和循環腫瘤DNA(ctDNA,circulating tumor DNA)對患者腫瘤進行診斷與監測的方法被稱為液體活檢。相比于傳統的活檢方法,液體活檢具有副作用小、操作簡單、能重復取樣等優點。

Credit: H. McDonald/Science Translational Medicine
最新研究證實,除了從已形成的實體瘤病灶(原發灶、轉移灶)脫落進入血液外,腫瘤細胞在形成實體瘤病灶之前便有可能進入血液系統中,由此提示循環腫瘤細胞的存在往往要早于影像學或臨床癥狀的表現。
近幾年CTC檢測在腫瘤輔助診斷、監控等方面的臨床表現逐漸嶄露頭角,是目前最具發展潛力的腫瘤無創診斷和實時監測手段之一。大量實驗已經證實CTC檢測有助于腫瘤的早期診斷、預后評估、療效監測及個體化治療方案制定等。

redit:Catherine Alix-Panabieres et al.
Clinical Chemistry. 2013;59(1):110-118.
CTC--腫瘤標志物
2007年ASCO將CTC納入腫瘤標志物。
|
腫瘤診斷方法 |
優點 |
缺點 |
|
影像學 |
①較快速
|
①特異性不足 ②對病灶大小有要求 ③結果普遍存在滯后性 ④射線對身體有損傷 |
|
病理學 |
①診斷金標準
|
①取樣會帶來創傷和擴散風險 ②很多早期患者無法取樣或取樣不足。 |
|
血清標志物 |
①自動化檢測,費用低廉 ②適用于大眾篩查 ③可為影像學提供參考數據 |
①有些腫瘤沒有特異性的血清學標志物 ②假陽性 ③特異性不足 |
|
循環腫瘤細胞(CTC)檢測 |
①非侵入性 ②可定性和定量 ③高敏感性、高特異性 ④好的腫瘤轉移指標 ⑤可實時動態監測 ⑥檢測診斷窗口提前 |
檢測費用較高 |
CTC被多個指南認可
2010年 美國AJCC《腫瘤分期指南》(第七版)
首次把CTC列入TNM分期系統,作為一個新的M分期(遠端轉移)標準,列為cM0(i+)分期,出現在M0和M1之間。
2017年 美國NCCN乳腺癌臨床實踐指南
正式引入cM0(i+)分期。
2018年 美國AJCC《腫瘤分期指南》(第八版)
明確CTC為乳腺癌預后評估工具之一:臨床晚期乳腺癌外周血CTC≥5個/7.5ml及臨床早期乳腺癌外周血CTC≥1個/7.5ml提示預后不良。
2018年 中華醫學會檢驗醫學分會/國家衛生健康委員會臨檢中心
《液體活檢在臨床腫瘤診療應用和醫學檢驗實踐中的專家共識》
CTC檢測可用于轉移性結直腸癌、乳腺癌與前列腺癌的進展/不良預后早期預警。
2019年 中國CSCO《乳腺癌診療指南》
CTC能夠反映腫瘤組織的情況,也可以用無創方式替代組織樣本進行病理診斷、疾病監測、分子測序等,不僅可以動態監測,還可以用于判斷預后。
CTC檢測可用于轉移性結直腸癌、乳腺癌與前列腺癌的進展/不良預后早期預警。
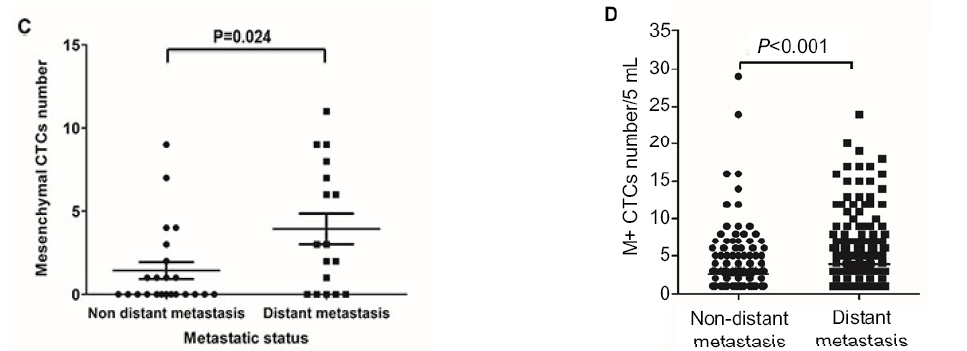
左圖:結直腸癌中間質表型的CTC預示著疾病更惡性與轉移潛能更強。
Zhao R, et al. Oncotarget. 2017 Feb 7;8(6):9293‐9302.
右圖:上皮間質轉化(EMT)表型CTC是乳腺癌遠端轉移的潛在生物標志物。
Zhang S, Wu T, et al. Cancer Manag Res. 2017 Nov 23;9:691‐700.
目前CTC的應用主要在以下幾個方面:
1. 在常規手段無法對早期腫瘤進行判斷時進行輔助診斷。
2. 在伴隨診斷、療效評估方面,癌癥患者進行化療、靶向治療后進行CTC 檢測,若CTC 數量減少,提示治療方式可能有效。相比于現階段的檢查手段,CTC 檢測技術操作更方便,應用更簡單,可以更及時地提示醫生該患者是否適合化療或靶向治療。
3. 在術后監測方面,主要是由于活檢無法高頻次檢測,而目前CTC 檢測在術后監測中應用可能更方便,檢測頻次會更高。
循環腫瘤細胞(CTC)的特性
1. 稀有性:每10mL血液中可能僅含有幾個到幾十個循環腫瘤細胞。
2. 非典型性的細胞形態:一般比血液細胞,正常組織細胞體積大;細胞核大,不規則,細胞核質比高;不易發生變形。
3. 異質性:細胞表面抗原標志物表達差異,攜帶不同的分子信息,轉移潛力差異。
4. 不同類別:CTC可以是間質型、上皮型或者上皮間質混合型,CTC也既可以是單個細胞的CTC也可以是成團的CTCs(CTM)。
CTC富集和檢測方法
人體循環系統中CTC的含量極低,腫瘤轉移患者每毫升全血中僅有1~10 個CTC,因此要實現CTC的檢測對其進行分選富集是一個必不可少的步驟。CTC分選富集效果的優劣將會直接影響其后續的檢測(計數、基因擴增、基因測序等)效果,因此高純度、高靈敏性(不丟失CTC)、快速、高細胞活性的CTC分選富集是CTC臨床應用的重點和難點。
CTC 的富集方法可以分為免疫親和富集法和物理特性富集法。免疫親和法主要是根據細胞表面表達的特異性的蛋白將CTC篩選出來,物理特性富集主要是根據CTC 的大小和密度等特性將這些細胞篩選出來。微流控芯片技術憑借多種優勢已經在CTC富集分選中得到越來越廣泛的應用,有望在將來成為CTC富集和檢測工具之一。
利用免疫親和或物理特性法可富集到CTC,接下來還需要結合有效的下游分析方法。一方面,由于目前CTC捕獲技術不能保證百分之百的純度,需要對所得到的細胞進行鑒定,以進一步確定CTC細胞的數目,以減少CTC數目判定的假陽性率和假陰性率。另一方面,在腫瘤的發生發展過程中,不僅CTC的數目在動態的變化,CTC所攜帶的分子標志物也在變化,通過對CTC表面標志物檢測,能夠反應腫瘤發生發展的動態變化,是研究腫瘤發生發展機制的有效策略,并能很好地指導臨床治療。
常用的CTC檢測技術如免疫熒光、PCR、FISH及高通量測序等。
1. 免疫熒光法(IF): 實體腫瘤細胞一般均為上皮來源,細胞內會表達角蛋(cytokeratin, CK)或其他腫瘤標示物(如HER2)。借助免疫熒光染色,可對來自實體瘤CTC中的瘤標進行識別,從而達到檢測CTC的目的。這也是目前檢測CTC的最常見方法。缺點是,在CTC形成過程的間質化(EMT)階段,大量的CK會降解,從而在CTC檢測過程中出現假陰性。
2. 熒光原位雜交(FISH): 熒光原位雜交,是根據已知細胞內特異的DNA序列,以利用熒光標記的特異寡聚核苷酸片段作為探針,與細胞內的基因組中DNA分子雜交,檢測該特異基因序列的存在與豐度。FISH技術與CTC結合,不僅可以檢測CTC表面標志物,也可以檢測CTC細胞內部的標志物及核型等。
3. RT-PCR,反轉錄PCR: 提取組織或細胞中的總RNA,以其中的mRNA作為模板,采用引物和逆轉錄酶將mRNA反轉錄成cDNA。再以cDNA為模板進行PCR擴增,而獲得目的基因或檢測基因表達。RT-PCR使RNA檢測的靈敏性提高了幾個數量級,使一些極為微量RNA樣品分析成為可能。結合RT-PCR可同時對若干個基因的表達進行檢測。位點特異性PCR技術可用于檢測CTC攜帶的驅動基因的突變情況。
4. 二代測序 : CTC數量少,直接進行二代測序難度大。需要將單細胞的DNA擴增后,再利用二代測序檢查基因序列。但是,目前單細胞測序的技術僅僅停留在實驗室階段,未來向市場推廣還有很長的路要走。而且由于腫瘤細胞的異質性,單細胞測序是否有代表性還需要更多的科學研究來證明。
CTC技術概述