CTC富集的方法學
一、CTC 富集方法的分類和原理
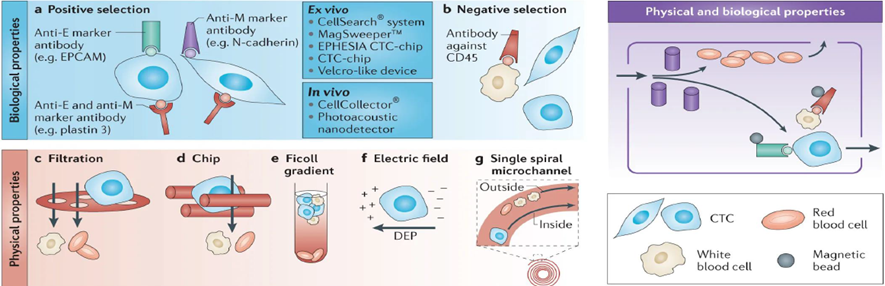
CTC 的富集方法可以分為生物化學特性富集法(親和性富集法)和物理特性富集法。
親和性(生物特性)富集法主要是根據通過細胞表面特異性表達的蛋白質生物標志物分離靶細胞,包括正向捕獲CTC 的陽性富集法和負向去除白細胞的陰性富集法。物理特性富集法主要是根據CTC 的大小、密度、力學和介電性能等物理特性將CTC 篩選出來。
二、CTC 富集技術的發展歷程和趨勢
2.1 發展歷程
從技術發展史來看,CTC 富集技術分為三代:第一代為基于物理特性的粗分離技術,第二代為基于生化特性的免疫磁珠技術,第三代為基于物理或生化特性的微流控芯片技術。
2.1.1 基于物理特性的粗分離技術
基于物理特性的粗分離技術通過特殊濾膜裝置、密度梯度離心將CTC 分離出來。這些技術操作簡單成本低廉,不依賴細胞表面抗原的表達,捕獲的細胞數量多,但是由于CTC 物理特性的異質性,難以富集到高純度的CTC。
2.1.2 基于生化特性的免疫磁珠技術
基于生化特性的免疫磁珠技術通過免疫磁珠偶聯的抗體或多肽正向或負向篩選出CTC。由于技術的限制,早期的磁珠只能達到微米級。隨著納米技術的發展,現在使用的磁珠大都為納米級,其增大的比表面積增加了與待測細胞的接觸幾率,更好的分散性降低了對細胞造成的機械性壓力,大大提高了CTC 的富集率。最典型的基于免疫磁珠富集CTC 的技術平臺是強生子公司veridex 的CellSearch,其是全球目前唯一同時經過FDA 和CFDA 批準的用于CTC檢測的商業化產品。該產品由于檢測靈敏度不高,且無法分離活體CTC,2016 年初已停產。除了CellSearch 之外,也有多種技術平臺基于免疫磁珠技術捕獲CTC,如AdnaGen 公司(已被Qiagen 收購)的AdnaTest,Miltenyi 公司的MACS,Illumina 公司的MagSweeper。
用于CTC 檢測的CellSearch 平臺。(A)將血液吸入含有EDTA 和細胞保護劑的CellSave 保護管中;(B)將7.5mL 血液轉移到單獨的管中并離心以分離固體血液成分和血漿;(C)樣品放入CELLTRACKS®AUTOPREP® 系統中,吸出血漿并將樣品重懸于緩沖液中(; D)添加偶聯EpCAM抗體的磁性納米顆粒并與EpCAM 陽性細胞結合,從而“富集”上皮來源的CTC。然后將磁珠結合的細胞與其他細胞通過磁性分離;(E)CTC 用CK8,CK18 和CK19 抗體染色。CD45 陽性染色細胞被認為是白細胞,并被排除在分析之外;(F)應用DAPI 染色細胞核;(G)施加磁力以分離磁珠結合的EpCAM 陽性細胞;(H)CK 陽性、DAPI 陽性、CD45 陰性的細胞被認為是CTC 用于進一步分析。
2.1.3 微流控芯片技術
微流控芯片技術基于CTC 的物理特性或生化特性或兩種特性的結合來富集CTC,所需樣品量小、流速可控而且能夠捕獲活細胞。微流控芯片技術目前已經歷了三代的發展過程:第一代芯片為以CTC-Chip 為代表,第二代芯片以HB-Chip 為代表,第三代芯片以CTC-iChip 為代表。
微流微柱富集:該類芯片基于CTC 與血細胞生化特性的差異,在芯片中設置微柱陣列將其從血液中分離出來。此類芯片以CTC-Chip 為代表,該芯片是第一個使用微流體技術富集CTC的裝置。CTC-Chip 由78,000 個微柱陣列組成,微柱被識別EpCAM 的抗體包被,微柱的幾何排列和流體流速被優化以促進細胞附著到抗體包被的柱上。除了CTC-Chip,也有一些公司開發基于微柱結構的芯片富集CTC,如Captura 公司的GEDI-Chip,Biocept 公司的OncoCEE。基于微柱結構的芯片由于復雜的微柱設計很難在大規模的基礎上進行高通量生產。此外,目前用于CTC 檢測和表征的技術嚴重依賴于免疫細胞化學和需要高分辨率成像的其他技術,這在非透明三維微柱陣列的存在下是困難的。
微流表面富集:由于基于微柱結構的芯片的局限性,表面捕獲的微流體芯片被開發,這些芯片使用抗體包被的表面裝置捕獲CTC。表面捕獲裝置的簡化架構更適合于大規模生產,并且還允許制造更易于成像的透明裝置。此類芯片以HB-Chip 為代表,其微流道的結構為魚骨形(HB),表面被識別EpCAM 的抗體包被,血液流過一個可視通道,通道內魚骨形溝回能夠引起血液的一個輕微斡旋,從而增強了其與抗體修飾表面的接觸。與第一代CTC 芯片相比,第二代的HB 芯片制作更為簡單,且可更高效地捕獲腫瘤細胞,捕獲效率約90%。后人在第二代的基礎上加上了aptamer(結合CTC 表面的EpCAM),進一步提高了CTC 的捕獲效率。
除了HB-Chip,GEM-Chip、GO-Chip 以及BioFluidica 公司的ModularSinusoidal Microsystem 也都采用表面裝置捕獲CTC。使用表面捕獲裝置的一個挑戰是下游處理的靈活性,捕獲的CTC被固定在裝置的表面上,并且難以恢復以進行進一步分析。在胰蛋白酶消化后可以釋放在這些裝置中捕獲的細胞,然而胰蛋白酶很可能切割用于后續分析的許多感興趣的表面受體。
微流免疫磁珠富集:目前已經有多家公司或研究單位應用免疫磁珠技術來解決表面捕獲裝置的局限性,該技術能很好地控制細胞捕獲與釋放。此類芯片以CTC-iChip 為代表,該芯片將免疫磁珠和微流控技術結合起來用于CTC 富集。CTC-iChip 首先使用塑料微柱陣列將小個的紅細胞和血小板過濾出去,然后在磁場中通過“慣性聚焦”作用將較大的細胞排成一行,并使用陽性或陰性富集方法分離CTC 與白細胞。CTC-iChip 的捕獲效率可以高達98%,但是對于直徑較小(<8 微米)的CTC 并不適用。除了CTC-iChip,也有多種芯片技術使用免疫磁珠富集CTC。如Ephesia 公司的Ephesia,Cynvenio 公司的LiquidBiopsy,Fluxion 公司的Isoflux,這些芯片的捕獲效率與第二代芯片相近,為90%左右。
上述芯片主要基于CTC 的生化特性將其從血液中分離出來,具有特異性高的優點,能有效分選形狀、大小相似的不同種類細胞。目前大部分技術采用EpCAM 作為CTC 的表面特異性抗原,但是在不同的腫瘤亞型中,EpCAM 的表達各不相同。依賴EpCAM 的CTC 分選芯片會丟失不表達或低表達EpCAM 的CTC,然而這些CTC 具有更大的浸潤性和侵入性。因此,缺乏公認的表面標志物限制了親和性富集在CTC 分選中的應用。
為了無需依賴表面標志物,也有一些微流控芯片基于物理特性富集CTC,目前主要有基于細胞大小和變形性差異的芯片技術,基于細胞力學性質的芯片技術和基于細胞介電性質的雙向電泳技術。
基于細胞大小和變形性差異的芯片技術:該技術通過在芯片內部設計不同的小于CTC 直徑的微孔、微過濾網、微柱等結構,當含有CTC 的樣品流經芯片時,CTC 由于直徑大而被卡在結構內,血細胞則隨緩沖液一起流出,較大的白細胞被結構捕獲時,由于CTC 比白細胞變形性小,加大緩沖液流速時,白細胞被沖走,CTC 則留在芯片內,從而達到分離目的。Abnova公司的ClearCell®CXSystem 就是基于此原理分離CTC 的代表,該系統還可以動態監測CTC 的捕獲過程。芯片主要結構由圓柱形微柱構成,每個捕獲單元由三個圓柱排列組成一個“爪形”結構。
基于細胞大小和變形性差異分選CTC 的優勢在于:操作過程簡單,捕獲效率高,能夠實現高通量富集,成本遠遠低于CellSearch,無需依賴表面標志物,分選出的CTC 可以用多種抗體進行標志物鑒別。該方法存在的問題是僅僅基于細胞尺寸和變形性不同而進行過濾式分選,由于CTC 尺寸和白細胞有重疊部分,CTC 有可能會通過濾網或微柱的間隔;而且在較大的機械力作用下,CTC 隨著緩沖液流過微柱或者濾網時容易破裂。這些因素會對分離純度和細胞活性造成一定影響,這類芯片在設計內部捕獲單元時應避免使用帶棱角的微柱,比如三角形、長方形、正方形等。
基于細胞力學性質的芯片技術:這些技術主要基于慣性力或確定性側向位移。基于慣性力的慣性微流技術通過使用兩種力(梯度剪切升力和管壁效應升力)在微流體裝置中應用慣性效應,基于尺寸被動地將CTC 與其他血細胞分離。這些升力的大小和方向取決于通道尺寸,通道縱橫比,流速和顆粒直徑。目前該技術的商業化平臺主要有Vortex(直線型通道)和ClearCellFX(單螺旋通道)。
基于確定性側向位移設計的微流控芯片原理是芯片內具有相對于流體流動方向呈一定角度的微柱陣列,尺寸不同的顆粒在流動過程中具有不同的運動軌跡,尺寸大的顆粒會發生側向位移向一側匯聚,尺寸小的顆粒會按原軌跡運動,在芯片上設計相應的兩個出口,即可收集到相應的細胞。
基于細胞力學性質差異分選同基于細胞大小和變形性差異分選一樣,裝置簡單、無需復雜的實驗設備、成本低。樣品無需標記,不影響CTC 分子特性和表面標志物;細胞在微流環境中損傷小,分選后細胞的存活率更高,可繼續培養和做后續分析。然而,由于血液的復雜性,細胞間的相互作用不容易控制,當處理細胞濃度較高的樣品時,分選效率降低。另外,該方法單純基于細胞的物理特性實現,而人體血液是高度復雜的血漿、紅白細胞、血小板、蛋白質混合物,且血液黏度是水的3 倍以上,因此芯片有時容易發生堵塞現象,影響分選效率,分選出的CTCs 可能存在假陽性結果。
基于細胞介電性質的雙向電泳技術:雙向電泳(DEP)是微流控芯片上一種常用的細胞分選方法,其原理是不同類型的細胞在電場中介電性質不同,所受介電力的大小和方向不同,在不同介電力作用下向不同方向移動,在電場中實現目的細胞的分選。目前,商業化的雙向電泳技術主要有ApoCell 公司的ApoStream,SiliconBiosystems 公司的DEPArray。
雙向電泳法最大的優勢是可將不同癌種表面標志物表達相同、尺寸相似、形態相似的細胞分離出來。但是在較大的流速下,微弱的電泳力沒有充足時間感應流過的CTC,從而難以達到快速分選。該方法存在的另一個問題是電場力可能會對細胞活性和表面特性產生影響,不利于對CTC 進行后續培養和分子特性分析。雙向電泳法分選時間長,但準確率高,因此,較適合于少量細胞的分選。
CTC 富集技術的發展歷程
2.2 發展趨勢
2.2.1 微流控芯片技術有望得到更廣泛應用
微流控芯片技術由于其自身特點在細胞分選方面具有一定的優勢,包括芯片體積小、速度快、通量高、操作簡便、樣品和試劑消耗低、易在芯片上集成多用途功能部件等.經過十多年的發展,該技術已經在CTC 分選中越來越廣泛的應用,有望在將來成為CTC 富集和檢測工具之一。該技術目前也面臨著一些技術上和臨床上的挑戰:芯片通道空間小,實驗過程中管道容易被堵塞;有些特殊的芯片造價昂貴不便于推廣應用;在進行細胞分選時,有些方法難以確保較高的細胞活性;缺乏統一的CTC 表面標志物等.如何改進微流控芯片技術在進行細胞分選時所遇到的上述問題,充分發揮其優勢,將是接下來研究的關鍵。
2.2.2 開發納米技術和適配體在微流控芯片中的應用
CTC 檢測的靈敏度和可靠性非常重要,7.5ml 血液中有1~5 個CTC 在臨床上都是有意義的,假陰性和假陽性都可能對樣品分析、臨床診斷產生重要影響。隨著納米技術的不斷發展,功能化納米材料修飾的微流控芯片廣泛應用于CTC 的富集和檢測。抗體連接的功能性納米粒子能夠為CTC 與抗體的結合提供更大的接觸表面積,因此納米技術也成為細胞分選中備受矚目的一項新技術。適配體能提供特異性CTC 靶點,因此微流控芯片的應用也許可以向基于新的CTC 捕獲探針(如核酸適配體探針等)方面發展,尋找特異性強的適配體探針,以提高CTC檢測的可靠性。
2.2.3 基于多種捕獲方法設計微流控芯片
親和性富集法特異性高,能有效分選形狀、大小相似的不同種類細胞,但是陽性富集法大都使用EpCAM,會丟失不表達或低表達EpCAM 的CTC,而陰性富集法只是去除了白細胞,CTC純度不高。物理特性富集法不依賴細胞表面標志物的表達,捕獲的細胞數量多,能夠克服CTC 在蛋白表達上的異質性,但是無法克服CTC 在物理特性的異質性。因此,采用多種捕獲方法相結合,充分利用各自的優點設計CTC 捕獲微流控芯片是將來的發展趨勢。如第三代芯片CTC-iChip,其利用確定性側向位移、慣性聚焦和免疫磁珠富集CTC。
1.1 親和性富集法
親和性富集法根據結合的靶細胞是CTC 還是白細胞,可分為陽性富集法和陰性富集法。
陽性富集法主要利用特異性抗體與腫瘤細胞表面抗原進行特異性結合來富集CTC。CTC 分為上皮細胞表型、間質細胞表型和上皮間質細胞混合表型,因此用于CTC 陽性富集的特異性抗體分為識別上皮標志物、識別間質標志物和識別上皮間質標志物三種。其中,上皮標志物在正常上皮細胞和上皮腫瘤(即癌)上表達,但在間質白細胞上不存在,因此經常用于區分癌細胞和正常血細胞。上皮細胞粘附分子(EpCAM)是最常用于上皮表型CTC 陽性富集的細胞表面標志物。此外,由于細胞骨架蛋白對于上皮細胞具有特異性,細胞角蛋白家族成員(即CK8,CK18 和CK19)已經成為檢測具有上皮表型癌癥患者CTC 的“金標準”標記物。
陰性富集法也稱白細胞去除法,通常用識別CD45 或CD14 的特異性抗體與白細胞結合,從而去除全血中的白細胞。
除了特異性抗體,親和性結富集法的某些技術采用與CTC 或白細胞表面抗原特異性結合的多肽或適配體(aptamer,一種單鏈DNA 或RNA 分子,與目的蛋白有很高的親和力和特異性)替代抗體來實現陽性或陰性富集。
1.1.1 免疫磁珠技術
親和性富集法目前基于免疫磁珠技術和微流控芯片技術對CTC 進行富集。免疫磁珠技術是根據免疫親和的原理,將免疫磁珠與捕獲抗體或特異性多肽(可與血液中的CTC 或白細胞表面抗原相結合)相連接,隨后通過磁場即可將磁珠捕獲與未捕獲的細胞分離。
1.1.2 微流控芯片技術
微流控(microfluidics)是一種精確控制和操控微尺度流體,以在微納米尺度空間中對流體進行操控為主要特征的科學技術。微流控芯片是微流控技術實現的主要平臺和技術裝置,因其樣品量小、流速可控及構件透明性等特點,已被廣泛應用于CTC 的分選富集中。微流體芯片技術基于親和性富集法分離CTC 時,芯片內部的微通道或微結構上修飾能夠與CTC 或白細胞表面抗原結合的特異性抗體或適配體,當血液流經芯片時,特異性抗體或適配體可與目的細胞表面抗原結合,隨后將CTC 或白細胞粘附在芯片上,實現CTC 的陽性捕獲或陰性富集。
1.2 物理特性富集法
物理特性富集法根據物理性質來分離CTC,包括大小、密度、力學和介電性質。從大小上來看,CTC 的直徑約為10-20μm,而血細胞大小為7-12μm,通過過濾可留下體積較大的CTC。從密度上來看,CTC 的密度較白細胞和紅細胞密度小,通過密度梯度離心可實現CTC 分離。除了大小和密度的差異,一些技術也利用CTC 和血細胞之間的力學和介電性質差異來捕獲CTC。具體來說,CTC 的可變形性不及血細胞。另外,CTC 的膜電容通常較血細胞低,在一定強度的電場中,其遷移率與血細胞會產生差異。微流控技術除了在親和性富集法中有廣泛應用外,在物理特性富集法中也有應用。微流控芯片根據CTC 與血細胞物理特性的差異,通過在芯片中設置不同的微結構單元將其從血液中分離出來,常用的微結構包括微孔、微過濾網和微柱等。
1.3 生化和物理特性相結合的方法
此外,也有一些技術將CTC 的物理和生物化學特性結合起來用于CTC 富集。如CTC-iChip,其基于CTC 大小和表面標志物的表達情況進行CTC 富集。該技術首先根據細胞大小,將較小的紅細胞和血小板過濾出去,留下白細胞和腫瘤細胞。然后,用識別EpCAM 的磁珠偶聯抗體對CTC 進行免疫染色,在磁場中捕獲并收集在芯片上。或者用識別CD45 的磁珠偶聯抗體去除白細胞后收集CTC